با سلام و درود خدمت شما دوستان عزیز. بار دیگر در خدمت شما هستیم با مقاله ای جدید و این بار با آموزش علوم نهم فصل دوم تحت عنوان رفتار اتم ها با یکدیگر. در کتاب علوم فصل دوم نهم آن چه اهمیت دارد یادگیری درست و بالا بردن درک دانش آموزان از پیوند های بین ذرات و رفتار ذرات در ساختار های متفاوت است. همه ما می دانیم که پایه نهم پلی است به سمت مباحث تخصصی تر دبیرستان. این درس نیز مفاهیم پایه شیمی را برای دانش آموزان روشن کرده تا در آینده ای نزدیک، مباحثی تخصصی تر را فرا گیرند.
آنچه در این فصل کتاب مطالعه می کنید:
- ذره های سازنده مواد
- اتم ها
- یون ها
- مولکول ها
- واکنش شیمیایی و ترکیب شدن اتم ها
- پیوند های شیمیایی
- واکنش شیمیایی
- قانون پایستگی جرم
جزوه علوم نهم فصل دوم
در ادامه می خواهیم توضیح مباحث اصلی این فصل کتاب را به صورت خلاصه وار برای شما ارائه دهیم تا بتوانید جزوه خوبی ازآن در بیاورید. البته تیم ما برای آن دسته از دانش آموزان پایه نهمی که حوصله نت برداری و نوشتن جزوه را ندارند، خلاصه نکات علوم تجربی فصل دوم را آماده کرده اند تا با مطالعه آن برای آزمون های کتبی و آنلاین آماده شوند. بهتر است زود تر شروع کنیم و طبق ترتیب بندی کتاب پیش برویم.
ذره های سازنده مواد
بخش اول علوم نهم فصل اول از سه بخش تشکیل شده:
- اتم ها
- یون ها
- مولکول ها
بیشتر بخوانید: آموزش فصل دوم ریاضی نهم
اتم ها
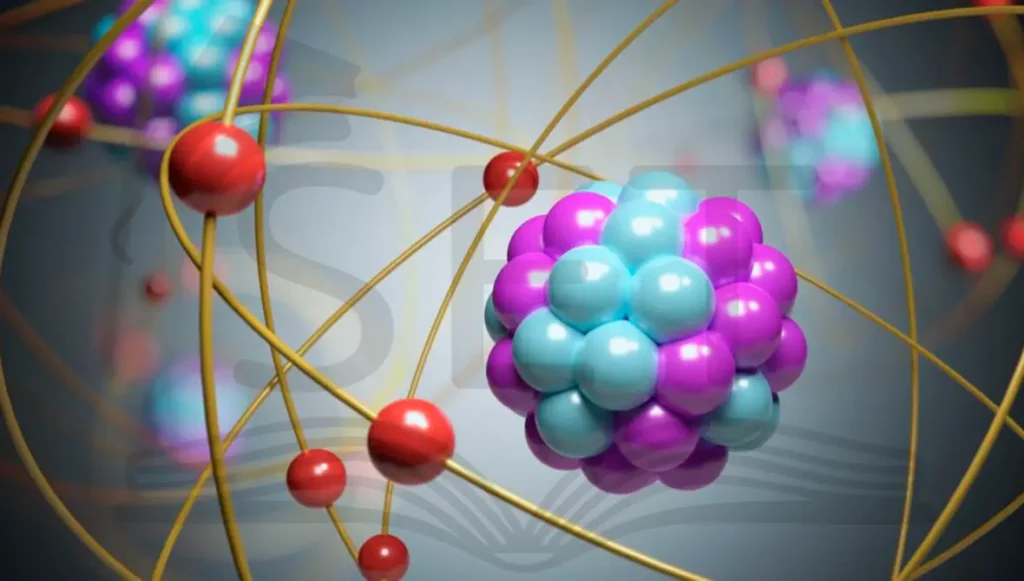
اتم، کوچک ترین ذره سازنده ماده است که ویژگی های شیمیایی یک عنصر را دارد. هر عنصر از اتم های مخصوص به خود تشکیل شده است. خود اتم نیز از سه بخش کوچک تر تشکیل می شود که شامل:
- پروتون: با بار مثبت و در هسته اتم قرار دارد. تعداد پروتون ها نشان دهنده عدد اتمی و هویت عنصر است و تقریبا نیمی از جرم اتم را تشکیل می دهد.
- نوترون: با بار خنثی و در هسته اتم قرار دارد. نیم دیگری از جرم اتم را نوترون ها تشکیل می دهند و با تغییر تعداد در هسته اتم، ایزوتوپ ها را می سازند.
- الکترون: با بار منفی و تقریبا بدون جرم، در اطراف هسته بر روی مدار های خاص در حال چرخش اند.
عدد های اتمی و جرمی
عدد اتمی(Z) = تعداد پروتون ها(معرف عنصر)
عدد جرمی(A) = تعداد پروتون ها+نوترون ها (این مقدار تقریبا برابر با جرم اتم است)
الکترون ظرفیت
همانطور که در کتاب علوم نهم فصل دوم اشاره شده؛ الکترون هایی که به دور هسته اتم در حال چرخش هستند درلایه(مدار) های مختلفی قرار دارند. بیرونی ترین لایه ای که الکترون در آن وجود دارد را لایه ظرفیت و الکترون های موجود در این لایه را الکترون ظرفیت می نامند. این الکترون ها نقش اصلی در واکنش های بین اتم ها را ایفا می کنند. تعداد الکترون های ظرفیت در این لایه تعیین می کند، یک اتم چگونه با دیگر اتم ها واکنش می دهد.
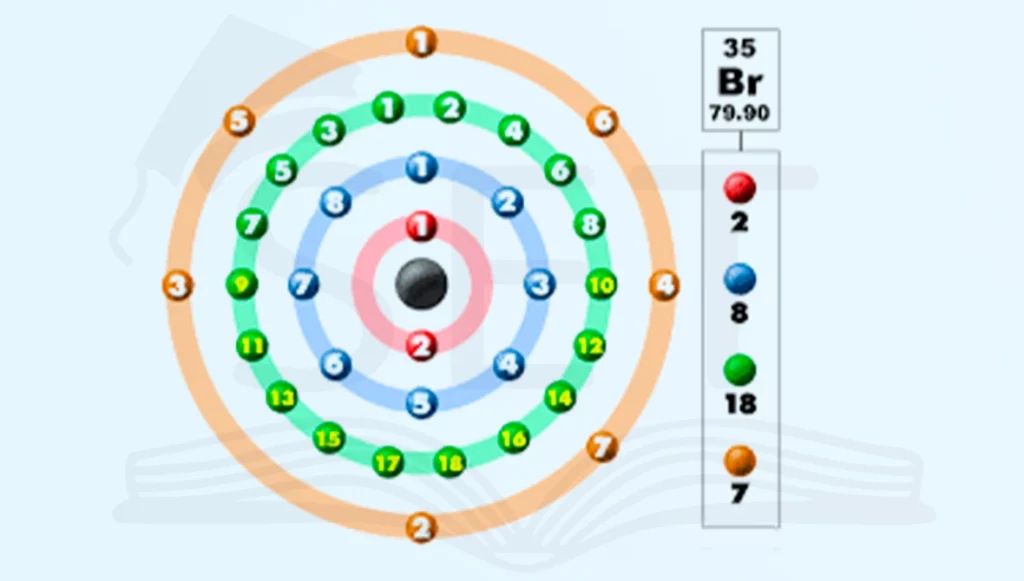
یون ها
یون ها همون اتم هایی هستند که تعداد الکترون و پروتون شون با هم برابر نیست یا به اصطلاح دارای بار هستند. یون ها نسبت به بار الکتریکی که دارند به دو دسته ی یون های مثبت(کاتیون) و یون های منفی(آنیون) تقسیم می شوند. حال به روش ساخت این یون ها می پردازیم.
اگر اتمی الکترون از دست بدهد ← تعداد پروتون ها از الکترون ها بیشتر می شود ← به یون مثبت (کاتیون) تبدیل می شود.
اگر اتمی الکترون بگیرد ← تعداد پروتون ها از الکترون ها کمتر می شود ← به یون منفی (آنیون) تبدیل می شود.
دلیل تشکیل یون ها
اتم ها به طور معمول دوست دارند به آرایش گاز های نجیب برسند(گاز های نجیب لایه ظرفیت پری دارند و بسیار پایدارند). به همین دلیل با از دست دادن و یا گرفتن الکترون قصد دارند به آرایش پایدار نزدیک ترین گاز نجیب برسند. برای مثال: فلزات اکثرا با از دست دادن الکترون به آرایش پایدار خود می رسند و نا فلزات با گرفتن الکترون.
بیشتر بخوانید: آموزش جامع درس دوم عربی نهم
مولکول ها
مولکول ها ذره هایی هستند که از دو یا چند اتم تشکیل شده و با هم پیوند شیمیایی تشکیل داده اند. مولکول ها هم می توانند از یک نوع اتم (مثل اکسیژن O2) تشکیل شده باشند و هم از چند نوع(مثل آب H2O). در ادامه کتاب علوم نهم فصل دوم درباره انواع پیوند های مولکولی توضیحاتی مختصر ارائه کرده که ما هم به آن اکتفا می کنیم، اما در ادامه به طور مفصلی درباره آن حرف می زنیم.
انواع پیوند های مولکولی
- پیوند های یونی
- پیوند های کوالانسی
در این بخش درس اول از علوم نهم فصل دوم تمام شد. شما عزیزان می توانید با تهیه کردن سوالات فصل دوم علوم نهم و تمرین، خود را برای امتحانات آماده کرده و بهترین نمره ها را دریافت کنید.

واکنش شیمیایی و ترکیب شدن اتم ها
درس بعدی علوم نهم فصل دوم به نحوه واکنش های اتم ها و ایجاد ترکیبات جدید می پردازد. همانطور که پیش تر به آن اشاره کردیم، اتم ها تمایل دارند آرایش لایه ظرفیت خود را به حالت گاز های نجیب برسانند. چه با از دست دادن الکترون، چه با گرفتن آن و چه با به اشتراک گذاشتن الکترون. حال این که اتم ها با چه روشی به این آرایش الکترونی برسند، نمایان گر روش واکنش های شیمیایی بین آن ها است. حال به توضیح دقیق تر ان می پردازیم.
انواع پیوند های شیمیایی
همانطور که گفتیم، اتم ها در تلاش اند که آرایش الکترونی خود را به یکی از گاز گاز های نجیب(هلیوم، آراگون، نئون و …) برسانند. این تغییر در آرایش اتمی هم آن ها را به پایداری می رساند و هم باعث ایجاد پیوند با دیگر اتم ها می شود. در ادامه انواع پیوند های شیمیایی موجود در بین اتم ها را برایتان بازگو کرده ایم.
پیوند یونی
اگر به خاطر بیاورید، در آموزش علوم نهم فصل اول به شما درباره نحوه ایجاد یون های مثبت (کاتیون) و یون های منفی (آنیون) اطلاعاتی داده شد. فلزات با از دست دادن الکترون به یون های مثبت و نا فلزات با گرفتن الکترون به یون های منفی تبدیل می شوند. بار های نا همنام یک دیگر را جذب می کنند و باعث ایجاد پیوندی الکتریکی بین اتم ها می شود که به آن پیوند یونی گفته می شود.
برای مثال:
اتم فلزی سدیم(Na) با از دست دادن یک الکترون به کاتین سدیم تبدیل می شود ← Na⁺
اتم نا فلز کلر(Cl) با گرفتن یک الکترون به آنیون کلر تبدیل می شود ← Cl⁻
بار های مثبت و منفی این یون ها با هم پیوند الکتریکی قوی ایجاد می کنند و نمک خوراکی (NaCl) را می سازند.
ویژگی های مواد یونی
- جامد های بلوری با نظم زیاد
- نقطه ذوب و جوش بالا
- محلول در آب
- رسانای جریان برق در حالت محلول یا مذاب
پیوند کوالانسی
پیوند دیگری که در علوم نهم فصل دوم به آن اشاره شده است پیوند کوالانسی در بین اتم های نافلزات است. تمام پیوند های بین اتم، فقط از نوع الکتریکی نیستند. نافلزات برای تکمیل لایه ظرفیت خود روش دیگری نیز دارند. این اتم ها الکترون مورد نیاز برای تکمیل لایه ظرفیت خود را با نافلزی دیگر به اشتراک می گذارند و با این کار هر دو به آرایش پایدار خود می رسند. در این نوع پیوند ها، دیگر یونی ساخته نمی شود بلکه با اشتراک الکترون ها در کنار رسیدن به آرایش دلخواه، حالت خنثی خود را حفظ می کنند.
مثال:
در مولکول آب دارای 1 اتم اکسیژن و 2 اتم هیدروژن است.
اتم اکسیژن(O) 6 الکترون دارد و برای رسیدن به آرایش 8 تایی خود به 2 الکترون نیاز دارد.
اتم هیدروژن(H) 1 الکترون دارد و برای رسیدن به آرایش پایدار به 1 الکترون نیاز دارد.
اتم اکسیژن و هر دو اتم هیدروژن الکترون های خود را به اشتراک همدیگر می گذارند و با این کار مولکول آب(H2O) شکل می گیرد.
ویژگی های مواد کوالانسی
- معمولا مولکولی هستند
- نقطه ذوب و جوش پایینی دارند
- در آب حل نمی شوند
- رسانای برق نیستند
بیشتر بخوانید: جزوه درس دوم مطالعات نهم
پیوند شبکه ای (اشتراک الکترون پیوسته)
در پایان پیوند های شیمیایی، پیوند شبکه ای معرفی می شود. در برخی از مواد، اشتراک الکترون مختص به چند اتم خاص(اتم های مولکول) نیست و این اشتراک در سرتاسر ساختار ماده ادامه دارد. به این نوع پیند ها، پیوند شبکه ای گوییند. از مواد مهم دارای پیوند شبکه ای که در علوم نهم فصل دوم به آن اشاره شده است، الماس و گرافیت است.
الماس از اتم کربن ساخته شده و هر اتم آن با 4 اتم کربن دیگر پیوند کوالانسی برقرار می کند. ساختار 3بعدی بسیار منظمی دارد و سخت ترین ماده طبیعی بر روی کره زمین است.
گرافیت نیز از کربن ساخته شده و هر اتم آن با 3 اتم کربن دیگر پیوند کوالانسی برقرار می کند. به همین دلیل لایه لایه است و هر لایه به راحتی بر روی لایه دیگر در حال لغزش است. گرافیت رسانای برق است و ماده اصلی مغز مداد است.
ویژگی های مواد دارای پیوند شبکه ای
- بسیار سخت محکم
- نقطه ذوب بسیار بالا
- ممکن است رسانای برق باشند(مثل گرافیت)
- مولکول مشخصی ندارند
واکنش های شیمیایی
واکنش شیمیایی زمانی رخ می دهد که اتم ها پیوند های قبلی خود را بشکنند و با اتم های دیگر پیوندی جدید ایجاد کنند. در این صورت مواد با یک دیگر واکنش داده و ماده یا موادی جدید با ساختار و ویژگی های متفاوت ایجاد می کند.
برای مثال: در واکنش زیر منیزیوم و اسکیژن با هم ترکیب شده و اکسید منیزیوم را می سازند.
O2+2Mg → 2MgO
توجه داشته باشید که در واکنش های شیمیایی، نوع و تعداد اتم ها ثابت می ماند، اما نحوه اتصال آن ها با یک دیگر تغییر می کند و ماده جدید با خواصی متفاوت را می سازد.
نشانه های وقوع واکنش شیمیایی
- تغییر رنگ
- تولید یا جذب گرما
- ایجاد نور
- تشکیل گاز یا حباب
- تشکیل رسوب جامد
بیشتر بخوانید: آموزش درس دوم زبان نهم

قانون پایستگی جرم
طبق گفته کتاب علوم نهم فصل دوم، در سال 1789 میلادی لاووازیه مطلبی را بیان کرد:
در هر واکنش شیمیایی، مقدار کل جرم مواد واکنشدهنده برابر با مقدار جرم مواد حاصل است.
امروز این مطلب را با عنوان قانون پایستگی جرم می شناسند. این قانون بیانگر این موضوع است که در واکنش های شیمیایی همواره جرم موادی که در واکنش ساخته می شود برابر است با جرم واکنش دهنده ها
برای مثال:
در واکنش بین اتم اکسیژن و هیدروژن برای تولید آب، تعداد و جرم اتم ها، قبل و بعد از واکنش با یکدیگر برابر است.
2H2 + O2 → 2H2O
سخن آخر
در این مقاله سعی کردیم تا با آموزش مفاهیم پایه و حیاتی این درس، شما را برای یادگیری مفاهیم پیچیده تر در آینده آماده کنیم. دانش آموزان پایه نهم باید بیشتر از قبل هوشیار باشند، چرا که در پایان امسال روند هدایت تحصیلی خود را در پیش دارند. این موضوع اهمیت پایه نهم بر روند آموزشی دانش آموزان را نشان می دهد. با این حال ما در تیم ست در تلاشیم تا بهترین محتوا را برای شما آماده کنیم.








یک پاسخ