شیمی دهم که از نظر عمده دانش آموزان پایه دهم رشته های تجربی و ریاضی شیرین ترین درس تخصصی می باشد،یکی از منابع کنکور و از دروس چالش برانگیز دوره متوسطه دوم می باشد.یکی از چالش هایی که عمده دانش آموزان با درس شیمی دارند،مفاهیم انتزاعی بسیار آن به نسبت سایر دروس می باشد. در راستای کمک به یادگیری عمیق و مفهومی شما،این مقاله به عنوان بررسی شیمی دهم فصل اول به تحریر درآمده است. سعی می شود در این مقاله ضمن معرفی این درس به آموزش مباحث مهم،ذکر مثال و معرفی منابع مفید بپردازیم.
- شیمی دهم چند فصل دارد
- بارم بندی شیمی دهم
- فصل اول شیمی دهم چه موضوعات مهم و حیاتی را پوشش میدهد
- درصد فراوانی شیمی دهم
- ایزوتوپ شیمی دهم
- جدول تناوبی شیمی دهم
- جرم اتمی
- مول شیمی دهم
- قاعده آفبا شیمی دهم
- ساختار لوییس شیمی دهم
- پیوند کووالانسی شیمی دهم
- پیوند یونی
- خلاصه نکات فصل اول شیمی دهم
- دانلود کتاب شیمی دهم
- منابع
- سخن آخر
شیمی دهم چند فصل دارد
کتاب شیمی دهم،به سه فصل به نام های:کیهان زادگاه الفبای هستی ، ردپای گاز ها در زندگی ، آب آهنگ زندگی، تقسیم می شود. عمده مطالب این کتاب بسیار جدید و متنوع هستند و پیشنیاز یکدیگر هستند؛به همین علت مطالعه مداوم و تدریجی بسیار برای این درس حائز اهمیت می باشد.
بارم بندی شیمی دهم
شیمی به عنوان یکی از دروسی که هم در کنکور هر دو رشته ریاضی و تجربی طرح می شود دارای اهمیت می باشد و همینطور به عنوان یکی از دروس چالشی در امتحانات نهایی خود نمایی می کند. با دانستن بودجه بندی کتاب می توان برنامه ریزی دقیق تر و منسجمی کرد؛هر چند که تسلط بر روی تمامی مباحث برای موفقیت در درس شیمی دهم بسیار ضروری میباشد،چرا که عمده سوالات ترکیبی طرح می شوند.سه فصل شیمی در سه زمان:دی ماه،خرداد ماه و شهریور ماه دارای بودجه بندی و بارم بندی متفاوتی هستند.
امتحانات دی ماه و یا نوبت اول:
- فصل اول:12 نمره
- فصل دوم:8 نمره
امتحانات خرداد ماه و یا نوبت دوم:
- فصل اول:5 نمره
- فصل دوم:7 نمره
- فصل سوم:8 نمره
امتحانات شهریور:
- فصل اول:6.5 نمره
- فصل دوم:6.5 نمره
- فصل سوم:7 نمره
باید توجه داشت که تفاوتی بین دروس شیمی دهم تجربی و شیمی دهم ریاضی وجود ندارد و هر دو رشته ضمن مطالعه یک کتاب واحد،دارای بودجه بندی یکسان نیز می باشند.همچنین شما برای افزایش آمادگی خود برای امتحانات می توانید از نمونه سوال آورده شده در لینک زیر استفاده کنید.
فصل اول شیمی دهم چه موضوعات مهم و حیاتی را پوشش میدهد
در این بخش سعی شده است تا چندی از مطالب پرتکرار و حائز اهمیت بسیار در نخستین فصل از شیمی دهم را ضمن معرفی،توضیح دهیم و با قرار دادن محتوا از وبسایت ست شما را در یادگیری دقیق و هدفمند این درس شیرین و پراهمیت یاری کنیم.
درصد فراوانی شیمی دهم
از اولین مباحث مطرح شده در شیمی دهم که کمتر به آن توجه می شود،میتوان به درصد فراوانی اشاره کرد.به صورت کلی میتوان دو تعریف بسیار ساده برای درصد فراوانی تعریف کرد.
1-از هر 100 اتم یک عنصر در حالت طبیعی(یعنی آزمایشگاهی نباشند) چندتا از آن ها از یک ایزوتوپ واحد و مشخص تشکیل شده اند.
2-سهم هر ایزوتوپ در کل ایزوتوپ های آن عنصر در حالت طبیعی.
به صورت کلی دو شکل رایج برای نمایش درصد فراوانی وجود دارد:
1-جمع تعداد اتم های در نمونه که عمدتا سوال میدهد. مانند: 5 اتم از ایزوتوپ x و 10 اتم از ایزوتوپ y که از طریق طیف سنجی انجام می شود.
2-درصد یا شیوه کسری
یک نکته کاربردی که در این موضوع وجود دارد این است که اول همیشه جمع کل را حسابی کنید و سپس وارد مراحل بعدی شوید تا دچار اشتباه نشوید.
نکاتی برای حل ساده تر سوالات درصد فراوانی:
1-همیشه نوع داده ورودی و خروجی را مشخص کنید تا خطا های رایج محاسباتی نشوید.
2-همیشه چک کنید که مجموع به 100% و یا کسر 1.00 برسد،در غیر اینصورت یعنی تمامی عوامل را دخیل نکرده اید.
3-حواستان باشد تا درصد و خود عدد را اشتباه با یکدیگر ننویسید
ایزوتوپ شیمی دهم
ایزوتوپ یکی دیگر از موارد زیربنایی و در عین حال ساده در شیمی دهم می باشد. در ادامه میخواهیم با توضیح و ذکر چند نکته مهم از ایزوتوپ ها، به معرفی شان بپردازیم.
بگذارید قبل از پرداختن به ایزوتوپ،مباحث گذشته و پایه ای را مرور کنیم.
1-عدد جرمی:به مجموع تعداد ذرات دارای جرم قابل لحاظ(پروتون و نوترون) که هر دو در هسته هستند، عدد جرمی می گویند. عدد جرمی را با نماد A نشان می دهند.
2-عدد اتمی: به تعداد پروتون های یک عنصر می گویند که مشخص کننده ویژگی های شیمیایی یک عنصر و همچنین نام آن عنصر می باشد. عدد اتمی را با نماد Z نشان می دهند.
حالا که مباحث گذشته را مرور کردیم،به معرفی خود ایزوتوپ میپردازیم. شرایطی را در نظر بگیرید که در آن یک اتم X با عدد جرمی A و عدد اتمی Z موجود است.این عنصر دو ایزوتوپ به نام های 1 و 2 دارد. تفاوت این دو ایزوتوپ در چیست؟ در عدد جرمی هر کدام؛تغییر عدد جرمی هم به تغییر نوترون آن اتم وابسته است زیرا که تغییر پروتون باعث عوض شدن خواص شیمیایی عنصر و ایجاد یک نمونه جدید از آن می شود.پس ما ایجاد ایزوتوپ را در تغییر عدد جرمی و یا همان نوترون های ان می دانیم. از مباحث فرضی کمی فاصله بگیریم و چند مثال بزنیم.
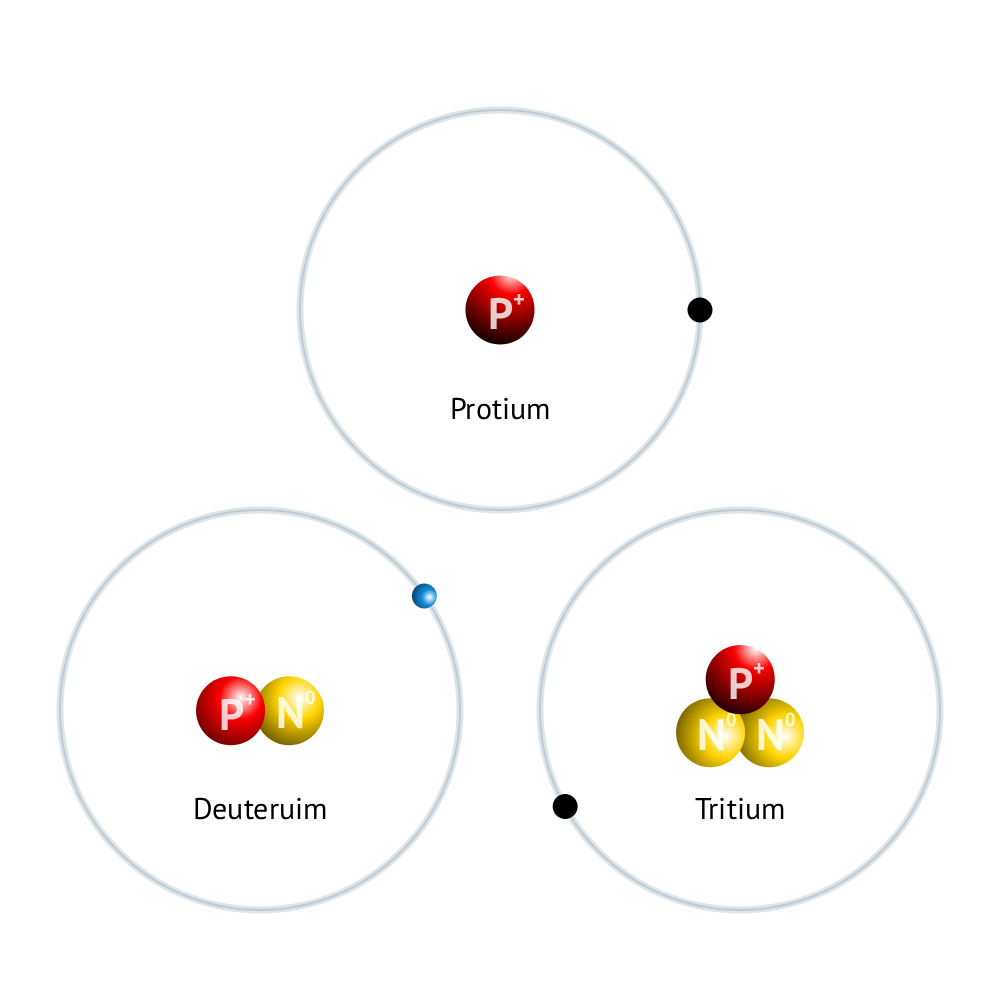
عنصر هیدروژن(H) دارای 3 ایزوتوپ متفاوت به نام های: پروتیوم-دوتریوم و تریتیوم می باشد.
پروتیوم:دارای 1 پروتون(شرط هیدروژن بودن) و 0 نوترون است. عدد جرمی آن برابر:0+1=1 می باشد.این ایزوتوپ پایدار می باشد.(شرط پایداری اتم ها نسبت پروتون به نوترون کمتر از 1.5 می باشد)
دوتریوم:دارای 1 پروتون و 1 نوترون است. در نتیجه عدد جرمی آن برابر 2 می باشد. این ایزوتوپ نیز پایدار است و اصطلاحا به آن هیدروژن 2 هم می گویند.هیدروژن 2 و یا دوتریوم دارای کاربرد در راکتورهای هسته ای(آب سنگین) می باشد.
تریتیوم:دارای 1 پروتون و 2 نوترون می باشد.این عنصر پرتوزا و ناپایدار می باشد و نام آن در عموم هیدروژن 3 می باشد.
همچنین عنصر کربن(C)در طبیعت دارای 3 ایزوتوپ می باشد که به معرفی آنها نیز خواهیم پرداخت.
1-کربن عدد اتمی(تعداد پروتون)6 دارد.در حالت طبیعی این اتم تعداد 6 نوترون نیز موجود است. با توجه مطالب فوق جرم اتمی این عنصر 6+6 و این عنصر پایدار می باشد.
2-کربنی با 6 پروتون و 7 پروتون و عدد جرمی 13 که پایدار می باشد.
3-کربن 14 که شامل 8 نوترون و 6 پروتون می باشد. این کربن تنها گونه پرتوزا در میان ایزوتوپ های طبیعی کربن می باشد. همچنین از این ایزوتوپ در تشخیص سن آثار باستانی استفاده می شود.
بررسی شباهت ها و تفاوت های ایزوتوپ ها نسبت به یکدیگر:
1-عدد اتمی یکسان در تمامی ایزوتوپ ها(شرط ایزوتوپ بودن هم عنصر بودن است)
2-تعداد پروتون نیز چون با عدد اتمی برابر است در تمامی نمونه ها یکسان است.
3-تعداد نوترون و عدد جرمی در ایزوتوپ باید متفاوت باشد.(تغییر عدد جرمی در گرو تغییر پروتون می باشد پس با یکدیگر ارتباط مستقیم دارند)
4-رفتار شیمیایی یکسان: بنا به گفته کتاب شیمی دهم و همچنین شیمی سالیان گذشته،نوترون مشخص کننده رفتار شیمیایی یک عنصر می باشد. پس چون شرط ایزوتوپ بودن عناصر،مقدار یکسان عدد اتمی آنها می باشد،پس رفتار شیمایی یکسانی دارند.
5-جرم اتمی: تغییرات جرم اتمی در گرو تغییرات پروتون است،همچنین افزایش جرم اتمی باعث تغییر برخی از خواص فیزیکی وابسته به جرم می شود. پس جرم اتمی در گونه های مختلف ایزوتوپ از یک عنصر متفاوت است.
جدول تناوبی شیمی دهم
جدول تناوبی بر اساس عدد اتمی عناصر چیده شده است و کاربرد آن در بررسی روابط بین عناصر می باشد. این نوع از جدول را دمیتری مندلیف معرفی کرد و پی برد که عناصر بر اساس جرم اتمی خود برخی خواص تکرار شونده ای را انجام می دهند که به آن تناوب می گویند. هر چند که بعد از کشف عدد اتمی متوجه شدیم که این تناوب بر اساس عدد اتمی می باشد. جدول تناوبی بسیار موضوع مفصل و طولانی است،اما در این مقاله قصد داریم به کتاب شیمی دهم اکتفا کنیم.
برخی از خواص جدول تناوبی:
1-ردیف های افقی جدول دوره نامیده میشوند.
2-جدول در حال حاضر دارای 7 دوره می باشد.
3-شماره دوره نشان دهنده عدد اتمی می باشد.
4-ستون های عمودی در جدول،گروه نامیده می شوند.
5-جدول دارای 18 گروه می باشد.
6-تمامی عناصر هم گروه،تعداد الکترون در آخرین لایه یکسانی دارند(پس رفتار شیمیایی مشابهی دارند)
7-در دوره افزایش عناصر مجاور با افزایش و کاهش 1 عددی پروتون(عدد اتمی اتفاق می افتد)
8-افزایش هم گروه ها های مجاور با افزایش تعداد الکترون های لایه ظرفیت اتفاق می افتد
اینک که برخی از ویژگی های کلی جدول را معرفی کردیم،میخواهیم به بررسی برخی از صفات و گروه ها بپردازیم:
1-گروه ها به سه دسته فلزات،نافلزات و شبه فلزات تقسیم می شوند.
2-فلزات با 84 عنصر و درصد 78 بزرگترین تقسیم بندی در جدول می باشند. تمامی این عناصر غیر از جیوه(Hg) جامد بوده.ویژگی های اصلی این عناصر:چکش خواری-براقیت-رسانایی حرارتی و الکتریکی و شکنندگی می باشد.
3-نافلز ها: این گروه با تعداد 17 عنصر،خواصی متضاد با فلزات دارند.این گروه شامل هر سه حالت جامد،مایع و گاز هستند.
4-شبه فلزات: این گروه 7 عنصر را شامل می شود و دارای خواصی ترکیبی از فلزات و نافلزات هستند.
جرم اتمی
تا به حال از خودتون پرسیدید که:”اتم هایی که انقدر ریز هستند،چطور جرمشان را اندازه گیری می کنند؟” پاسخ به این سوال را کتاب شیمی دهم اینگونه می گوید: اندازه گیری مستقیم جرم یک اتم تقریبا نشدنی است.بنابراین با توجه به مقوله شمارش ذرات که در کتاب درسی توضیح داده شد دست به راه حل دیگری زدند؛آنها به این نتیجه رسیدند که تقریبا یک دوازدهم جرم یک کربن دوازده برابر با یک واحد جرم اتمی می باشد(به صورت گرد شده برابر با عدد جرمی عناصر)
همچنین یک مفهوم دیگر به نام جرم اتمی میانگین در شیمی دهم مطرح می شود که از طریق رابطه زیر قابل استنباط است:
جرم اتمی میانگین=(m1×f1)+(m2×f2)+…
که در رابطه بالا f برابر با درصد فراوانی عنصر و m با جرم اتمی عنصر برابر می باشد.
مول شیمی دهم
از مباحث جدید و بسیار حائز اهمیت در شیمی دهم،مبحث مول می باشد. لذا در این مقاله به معرفی و حل چند مثال از آن خواهیم پرداخت.
بگذارید سوالی دیگر از شما بپرسیم:آیا تعداد اتم ها یا مولکول های موجود در یک ماده را می توان مستقیم شمرد؟ پاسخ مجددا خیر است. پس برای همین دانشمندان واحد و رابطه ای را به وجود آوردند که بتوان به کمک آن این کار را انجام داد. هر مول از هر ماده شامل 10-23 * 6.022 ذره می باشد که به آن عدد آووگادرو گفته می شود. همچنین اگر جرم اتمی به گرم تبدیل شود با جرم مولی برابر است.
مثال اول
در 1 مول آب چند مولکول و چند اتم وجود دارد؟
حل:
1-هر مول آب به تعداد عدد آووگادرو مولکول دارد
2-هر مولکول آب 3 اتم دارد(2 هیدروژن و 1 اکسیژن)
3-تعداد اتمها در ۱ مول آب=3×6.022×1023=1.807×1024
مثال دوم
جرم یک مول مولکول اکسیژن در مبنای گرم چقدر است؟
حل:
16 * 2 = 32
چرا که تعداد ذرات 2 عدد(O2) و جرم اتمی اکسیژن = 16amu
قاعده آفبا شیمی دهم
قاعده آفبا یکی از اساسی ترین و جدیدترین مفاهیم در شیمی دهم می باشد،لذا برای جلوگیری از پر حرفی ، توضیحات اضافی را به فایل پیوست آخر این بخش ارجاع میدهیم و اینجا صرفا به معرفی قاعده آفبا به اندازه کتاب شیمی دهم خواهیم پرداخت.
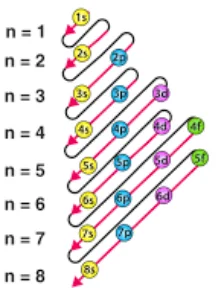
الکترون ها در اتم به ترتیب افزایش انرژی زیرلایه ها پر می شوند. یعنی:با ابتدا زیرلایه هایی با انرژی کمتر پر می شوند و سپس زیرلایه های پر انرژی.ترتیب پر شدن زیرلایه ها در شکل زیر آورده شده است.
اجازه بدهید تا برای تثبیت بیشتر موضوع از دو مثال استفاده کنیم
مثال اول:عنصر کلر با عدد اتمی 17 چه آرایش الکترونی دارد؟
جواب:1s² 2s² 2p⁶ 3s² 3p⁵
مثال دوم:عنصری با عدد اتمی 11 آرایشش چه شکلی خواهد بود؟
جواب:1s² 2s² 2p⁶ 3s¹
ساختار لوییس شیمی دهم
کاربرد ساختار لوئیس برای یک نمایش ساده و سریع از نحوه قرارگیری انرژی های لایه ظرفیت است که عمدتا برای بررسی موارد زیر به کار می رود:
1-نمایش الکترون های اشتراکی
2-بررسی رسیدن به ساختار گاز نجیب(تعادل عنصر)
مراحل رسم ساختار لوییس:
1-شمارش الکترون های لایه ظرفیت.
2-تعیین اتم مرکزی:اتمی که توانایی ایجاد بیشترین پیوند را داشته باشد.
3-اتصال اتم ها به یکدیگر
4-مشخص کردن رسیدن به آرایش گاز نجیب
با دقت در شکل های زیر میتوانید به تسلط بیشتر در زمینه ساختار لوئیس برسید.
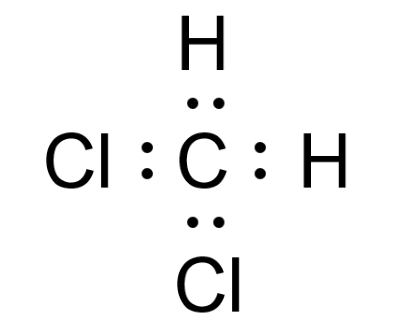

پیوند یونی شیمی دهم
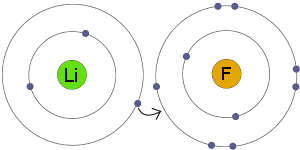
در گذشته در رابطه با ساختار های یونی مقداری آموختید،شما در شیمی دهم به مباحث وسیع تری در رابطه با این پیوند دسترسی پیدا می کنید.
در رابطه با پیوند یونی میدانیم که به تبادل الکترون بین فلز و نافلز برای رسیدن به آرایش گاز نجیب گفته می شود.در اصل این تبادل الکترون برای تعادل بار الکتریکی می باشد. عناصری که الکترون دریافت می کنند بار منفی(زیرا بار الکترون منفی می باشد) و آنیون نامیده می شوند؛عناصری که الکترون از دست میدهند بار مثبت(به دلیل مثبت بودن بار پروتون و افزایش تعداد پروتون به الکترون) کاتیون می گویند. عمدتا در جدول تناوبی عناصر فلزی کاتیون و نافلزات آنیون هستند.
چند گام ساده برای فهم یونی بودن ترکیب:
1-عنصر کاتیون و آنیون را مشخص کنید.
2-بار های آنیون و کاتیون را بنویسید
3-بررسی کنید که حتما جمع بار های آنیون و کاتیون برابر شود.
ویژگی های پیوند های یونی:
1-نقطه ذوب و نقطه جوش بالا دارند.
2-در حین سختی،شکننده هستند(مانند فلزات)
3-در حالت جامد رسانای الکتریسیته نیستند اما با محلول شدن و یا ذوب رسانا می شوند.(مانند نمک)
4-می توانند در حلال های قطبی حل شوند.
پیوند کووالانسی شیمی دهم
پیوند کووالانسی به عنوان آخرین مبحث توضیح داده شده در شیمی دهم است. پیوند کووالانسی نوعی دیگر از پیوند است که اتم به جای تبادل مستقیم الکترون ها،آنها را بین یکدیگر به اشتراک میگذارند. عمده پیوند کووالانسی بین نافلز ها اتفاق می افتد.اتم ها بر اساس تعداد جفت اشتراکی به سه حالت:یگانه،دوگانه و سه گانه تقسیم می شوند.
خلاصه نکات فصل اول شیمی دهم
مطالعه خلاصه نکات ضمن مرور سریع باعث افزایش تثبیت موضوع در ذهن فرد می شود،همچنین از دیگر مزایای خلاصه نکات میتوان به آشنا شدن بیشتر دانش آموز با ذهنیت دبیران درس شیمی دهم اشاره کرد؛البته تمامی این موارد در گرو این است که یک استاد خوب این خلاصه نکات را طرح کرده باشد. ما افتخار این را داریم که در ست از اساتید مجرب استفاده کنیم و شما می توانید خلاصه نکات این درس از شیمی دهم را از لینک زیر دریافت کنید.
همچنین توصیه می شود حتما برای افزایش تمرکز و افزایش بازدهی مطالعه خود،به لینک زیر مراجعه کنید.
دانلود کتاب شیمی دهم
مسلما اولین و دقیق ترین منبع برای تمام دانش آموزانی که میخواند به شیمی دهم تسلط پیدا کنند کتاب درسی می باشد. شما می توانید برای تثبیت بیشتر موضوعات و همچنین سهولت حمل و نقل،فایل کتاب درسی را از لینک زیر دانلود کنید.
منابع
2-راهنمای معلم شیمی 1
کلام آخر
در این مقاله سعی تا صرف نظر از معرفی فصل اول شیمی دهم،به توضیح کاربردی و مفهومی برخی از مفاهیم بسیار مهم که در این فصل به آنها پرداخته شد بپردازیم،همچنین منابعی برای مطالعات تکمیلی و اخذ نمرات بالا در امتحانات معرفی شد.امیدواریم که تک تک شما عزیزان بتوانید با استفاده از این مقاله و تلاش و استمرار به نمرات بالا در این درس دست یابید








یک پاسخ